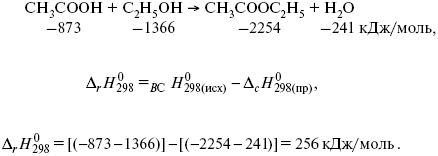
Законы Гесса – основополагающие принципы химии, которые позволяют определить изменение энергии в процессе химической реакции. Эти законы были сформулированы немецким химиком Германом Гессом в 1840 году и до сих пор являются основой для понимания и объяснения различных химических явлений.
Первый закон Гесса утверждает, что изменение энергии в химической реакции не зависит от пути, по которому происходит эта реакция. Это значит, что если реакция происходит через несколько промежуточных шагов, то изменение энергии в конечном итоге будет таким же, как если бы реакция происходила непосредственно.
Второй закон Гесса заключается в том, что если химическая реакция можно разложить на несколько независимых реакций, то изменение энергии для всей реакции будет равно сумме изменений энергии для каждой из этих независимых реакций. Это позволяет упростить расчеты и оценить энергетическую эффективность сложных химических процессов.
Законы Гесса имеют широкое применение в химической термодинамике и кинетике. Они позволяют предсказывать и объяснять термодинамические свойства реакций, такие как энтальпия и энтропия, и определить переходные состояния и стабильность химических соединений. Благодаря этим законам химики могут разрабатывать эффективные источники энергии, улучшать производство и синтез химических веществ, а также предсказывать поведение веществ при различных условиях.
Что такое законы Гесса?
Первый закон Гесса, или закон аддитивности энтальпий, утверждает, что общая энтальпия реакции равна сумме энтальпий реакций, которые происходят в несколько этапов и приводят к той же конечной продукции. То есть, если реакция A → C может пройти через промежуточные этапы A → B и B → C, то изменение энтальпии для реакции A → C будет равно сумме изменений энтальпий для реакций A → B и B → C.
Второй закон Гесса, или закон энтальпийных сумм, утверждает, что изменение энтальпии для реакции зависит только от состояния начальных и конечных веществ и не зависит от пути, по которому происходит реакция. То есть, если реакция A → B может пройти напрямую или через промежуточное состояние C, то изменение энтальпии для реакции A → B будет одинаковым независимо от выбранного пути.
Законы Гесса широко используются для расчета энергетических характеристик химических реакций и определения термодинамической стабильности соединений.
Общее представление о законах Гесса
Основная идея законов Гесса заключается в том, что изменение энергии составляющих химическую реакцию может быть вычислено путем суммирования изменений энергии более простых реакций. Это означает, что энергия является функцией состояния, и ее изменение не зависит от пути реакции.
По формулировке законов Гесса, изменение энергии реакции равно разнице между суммой энтальпий образования продуктов и суммой энтальпий образования исходных реагентов. Эта разница в энергии называется энтальпией реакции.
Законы Гесса имеют широкое применение в химии. Они позволяют определить энергетические характеристики химических реакций, предсказать возможность и направление реакций, а также обосновать термодинамическую стабильность соединений.
Важно отметить, что законы Гесса основаны на предположении, что теплообмен в химических реакциях происходит без изменения объема системы и что реакции происходят при постоянной температуре и давлении. Однако, в реальных условиях могут быть отклонения от идеальности, поэтому законы Гесса применяются с некоторыми ограничениями.
Исторический контекст создания законов Гесса
Законы Гесса, также известные как законы термодинамики, были разработаны немецким химиком и физиком Германом Гессом в XIX веке. В это время мир находился в эпоху промышленной революции и прогрессивные идеи о тепловом движении и энергии стали приходить на смену устаревшим понятиям о флогистоне и калории.
Гесс начал свои исследования в области химических реакций и тепловых эффектов в 1830-х годах. Его основным интересом были изомерические превращения, при которых вещества с одинаковыми молекулярными формулами, но различными структурами, обладают различными тепловыми эффектами.
В ходе своих экспериментов Гесс заметил, что тепловые эффекты реакций зависят только от исходных и конечных состояний системы, а не от пути, по которому происходит реакция. Это стало основой для формулировки законов Гесса, которые позволили предсказывать и вычислять тепловые эффекты химических реакций.
Для более удобного представления своих результатов и общего понимания законов, Гесс использовал таблицы с тепловыми эффектами различных реакций. В этих таблицах он отразил изменение внутренней энергии системы, энтальпию, энергию активации и другие параметры.
Работы Гесса были признаны важными для развития термодинамики и химии в целом. Его законы были включены в основу термодинамических принципов и стали стандартными во всех учебниках и учебных программах по химии и физике по всему миру.
| Реакция | Изменение энтальпии |
|---|---|
| A + B → C | ΔH1 |
| C → D | ΔH2 |
| B → D | ΔH3 |
| A + B → D | ΔH4 |
Формулировка основных законов Гесса
Первый закон формулируется следующим образом: «Если два вещественных элемента реагируют, образуя определенное количество конечных продуктов, то тепловой эффект этой реакции не зависит от промежуточных стадий процесса и может быть вычислен путем сложения реакционных тепловых эффектов, связанных с образованием или разложением конечных продуктов».
Второй закон Гесса утверждает: «Если химическая реакция может быть представлена как последовательность двух или более стадий, то реакционный тепловой эффект этой реакции равен сумме тепловых эффектов для каждой отдельной стадии».
Третий закон Гесса гласит: «Если химическая реакция может быть разложена на две или более независимых реакции, то реакционная тепловая энергия для полной реакции равна алгебраической сумме тепловых эффектов для каждой отдельной реакции».
Законы Гесса являются важными инструментами в химии, позволяющими предсказывать и вычислять тепловые эффекты реакций. Они существенно облегчают изучение и анализ химических процессов.
Первый закон Гесса
Первый закон Гесса, также известный как закон суммы тепловых эффектов химических реакций, устанавливает, что изменение энтальпии при химической реакции не зависит от пути, по которому происходит реакция. Это означает, что изменение энтальпии (ΔH) реакции можно рассчитать путем сложения тепловых эффектов реакций, включенных в реакцию, без учета промежуточных стадий.
Формулировка первого закона Гесса:
- Если химическое уравнение можно разложить на несколько промежуточных реакций, то изменение энтальпии реакции равно сумме изменений энтальпии промежуточных реакций.
- Если химическое уравнение можно составить несколькими способами, то изменение энтальпии реакции при любом из этих способов будет одинаково.
Первый закон Гесса позволяет использовать экспериментально измеряемые тепловые эффекты реакций для расчета энтальпий реакций, которые невозможно измерить непосредственно. Также он позволяет предсказывать тепловые эффекты реакций, которые еще не были исследованы.
Второй закон Гесса
Другими словами, если реакция происходит через несколько промежуточных стадий, то изменение энтальпии в конечном счете будет таким же, как если бы реакция происходила непосредственно между начальными и конечными веществами.
Второй закон Гесса можно выразить следующей формулой:
| ∆H (абс) = ∑∆H (пр) |
где:
- ∆H (абс) — изменение энтальпии реакции;
- ∆H (пр) — изменение энтальпии каждой промежуточной стадии.
Второй закон Гесса находит широкое применение в химической термодинамике. Он позволяет определить изменение энтальпии реакции, используя известные значения энтальпии других реакций или веществ. Это особенно полезно, когда прямое измерение энтальпии реакции невозможно или затруднительно.
Третий закон Гесса
Третий закон Гесса утверждает, что изменение энтальпии реакции (ΔH) не зависит от пути превращения и температуры реагентов.
Математически третий закон Гесса формулируется следующим образом:
| Величина | Значение |
|---|---|
| ΔH0(A → C) | ΔH0(A → B) + ΔH0(B → C) |
Где ΔH0 обозначает стандартное изменение энтальпии реакции, A, B и C — различные состояния системы.
Третий закон Гесса позволяет применять косвенные методы измерения энергии реакций, особенно тех, которые невозможно измерить непосредственно. Также этот закон используется для расчета энтальпий различных химических реакций по данным стандартных энтальпий образования веществ.
Вопрос-ответ:
Какую роль играют закои Гесса в химических реакциях?
Законы Гесса позволяют определить тепловое изменение реакции и связаны с температурными изменениями при ее проведении.
Какая суть законов Гесса?
Суть законов Гесса заключается в том, что тепловое изменение, происходящее при переходе от одних субстанций к другим, не зависит от прохождения реакционного пути и равно разности тепловых изменений, связанных с температурными изменениями при отдельных этапах.
Как формулируются законы Гесса?
Первый закон законов Гесса гласит, что тепловое изменение реакции равно алгебраической сумме тепловых изменений, происходящих при отдельных этапах реакции. Второй закон гласит, что при изменении состояния системы в косвенном пути суммарное тепловое изменение остается неизменным.
Как применяются законы Гесса в химии?
Законы Гесса применяются для расчета тепловых эффектов химических реакций, а также для определения энтальпии образования и энтальпии сгорания веществ.
Какие примеры применения законов Гесса можно найти в химии?
Например, законы Гесса могут быть использованы для расчета энтальпии сгорания углеводородов, определения энтальпии образования ионов, а также для определения теплового эффекта реакций, которые невозможно измерить напрямую.
Какие законы Гесса существуют?
Существуют два закона Гесса: закон Гесса для формирования и разрушения химических связей и закон Гесса для тепловых эффектов реакций.
Какой принцип закона Гесса используется для формирования и разрушения химических связей?
Принцип закона Гесса, используемый для формирования и разрушения химических связей, заключается в том, что энергия, связанная с формированием или разрушением химических связей, не зависит от пути реакции, а зависит только от начальных и конечных состояний системы.