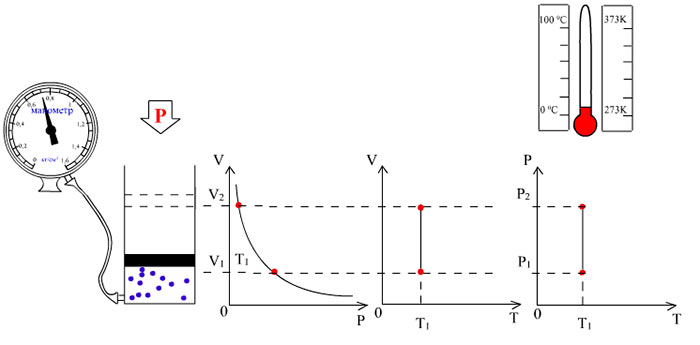
Закон Бойля-Мариотта является одной из фундаментальных закономерностей физики и химии. Он описывает связь между давлением и объемом идеального газа при постоянной температуре. В самом простом понимании, закон Бойля-Мариотта гласит, что при увеличении давления на газ, его объем уменьшается, а при уменьшении давления — увеличивается.
Закон Бойля-Мариотта назван в честь французского физика и химика Роберта Бойля и английского физика и химика Эдварда Мариотта, которые независимо друг от друга открыли и описали этот закон в 17 и 18 веках соответственно.
Для лучшего понимания закона Бойля-Мариотта, представьте себе раздуваемый воздушный шарик. Когда вы накачиваете воздух в шарик и закрываете клапан, давление внутри шарика увеличивается, что приводит к уменьшению его объема. Если же вы откроете клапан и выпустите часть воздуха, давление внутри шарика уменьшится и его объем увеличится.
Закон Бойля-Мариотта: основное понятие
Закон Бойля-Мариотта представляет собой физическую закономерность, которая описывает взаимосвязь между давлением и объемом газа при постоянной температуре. Согласно этому закону, при постоянной температуре количество газа (его масса) остается неизменным, а его объем прямо пропорционален давлению.
Математически закон Бойля-Мариотта может быть выражен следующим образом: P1 * V1 = P2 * V2, где P1 и V1 — начальное давление и объем газа, P2 и V2 — конечное давление и объем газа. Из этого уравнения следует, что при увеличении давления объем газа уменьшается, а при уменьшении давления — увеличивается.
| Давление (P) | Объем (V) |
|---|---|
| Увеличение | Уменьшение |
| Уменьшение | Увеличение |
Применение закона Бойля-Мариотта широко распространено в научных и технических областях. Он позволяет предсказывать, как изменится объем газа при изменении его давления при постоянной температуре. Этот закон имеет значительное практическое применение, например, в аэронавтике, химической промышленности и медицине.
Каково суть закона Бойля-Мариотта?
Закон Бойля-Мариотта, также известный как закон Бойля, устанавливает прямую зависимость между давлением и объемом газа при постоянной температуре. Суть закона заключается в том, что при постоянной температуре количество газа увеличивается или уменьшается прямо пропорционально изменению давления на него.
Математически закон Бойля-Мариотта можно выразить формулой:
| Исходное состояние | Итоговое состояние |
|---|---|
| P1 * V1 = P2 * V2 | P1 — давление в исходном состоянии V1 — объем в исходном состоянии P2 — давление в итоговом состоянии V2 — объем в итоговом состоянии |
Таким образом, если увеличить давление на газ, его объем уменьшится, а если уменьшить давление, объем увеличится. Закон Бойля-Мариотта является одним из основных законов газовой динамики и широко применяется в науке, технике и промышленности.
Закон Бойля-Мариотта: определение и принцип
Согласно закону Бойля-Мариотта, при фиксированной температуре, давление и объем идеального газа обратно пропорциональны друг другу. Иными словами, если объем газа уменьшается, то его давление увеличивается, и наоборот, при увеличении объема давление уменьшается. Закон может быть математически представлен уравнением:
| Давление | Объем |
|---|---|
| P1 | V1 |
| P2 | V2 |
Где P1 и P2 представляют начальное и конечное давление, а V1 и V2 — начальный и конечный объем.
Определение и принцип закона Бойля-Мариотта важны в различных областях науки и техники, таких как химия, физика и инженерия. Знание этого закона позволяет спрогнозировать изменение давления или объема в системе газов при изменении условий, что существенно для многих практических приложений.
Закон Бойля-Мариотта: идеальный газ и его свойства
Идеальный газ — это модель, используемая в физике для упрощенного описания поведения газов. В идеальном газе предполагается, что отдельные молекулы не взаимодействуют друг с другом, а их объемы самих молекул пренебрежимо малы по сравнению с объемом системы в целом. Также идеальный газ считается невязким и совершенно упругим.
Согласно закону Бойля-Мариотта, при постоянной температуре объем идеального газа обратно пропорционален его давлению. Если давление увеличивается, то объем газа уменьшается, а если давление уменьшается, то объем газа увеличивается. Математический вид закона Бойля-Мариотта можно представить следующим образом:
P1 * V1 = P2 * V2
где P1 и V1 — начальное давление и объем газа, а P2 и V2 — конечное давление и объем газа.
Закон Бойля-Мариотта позволяет предсказывать изменения в объеме газа при изменении давления и наоборот. Также он полезен для решения различных проблем, связанных с измерением и контролем давления и объема газовых систем.
Следует отметить, что закон Бойля-Мариотта работает только для идеального газа. В реальности газы не всегда ведут себя идеально из-за наличия межмолекулярных взаимодействий и других факторов. Однако в большинстве случаев закон Бойля-Мариотта дает достаточно точные результаты и является полезным инструментом для изучения газовых процессов.
Закон Бойля-Мариотта: формула и применение
Математическое представление закона Бойля-Мариотта имеет вид:
P1 * V1 = P2 * V2
где P1 и V1 — изначальное давление и объем газа, а P2 и V2 — конечное давление и объем газа. Если известны любые три из этих параметров, можно определить четвертый.
Этот закон находит применение во множестве сфер, включая химию, физику, технику и биологию. Например, он может использоваться для расчета объема газа при изменении давления или для определения давления при изменении объема газа. Также этот закон является основой для объяснения многих явлений и процессов в науке и промышленности, таких как работа автомобильного двигателя, процессы нагревания и охлаждения, аэродинамика и другие.
Использование закона Бойля-Мариотта позволяет предсказывать и объяснять поведение газов и проводить различные расчеты, что делает его важным инструментом в научно-исследовательской работе и промышленности.
Как выразить закон Бойля-Мариотта в формуле?
Закон Бойля-Мариотта устанавливает зависимость между давлением и объемом газа при постоянной температуре. Он может быть выражен следующей формулой:
P1 * V1 = P2 * V2
где P1 и V1 — начальное давление и объем газа, P2 и V2 — конечное давление и объем газа.
Эта формула показывает, что при постоянной температуре произведение давления и объема газа остается неизменным. Если давление увеличивается, то объем газа уменьшается, и наоборот.
Закон Бойля-Мариотта является одним из базовых законов газовой теории и имеет широкое применение в научных и инженерных расчетах, а также в ежедневной жизни.
Зиценко и уравнение Бойля-Мариотта
Уравнение Бойля-Мариотта описывает математическую зависимость между давлением и объемом идеального газа при постоянной температуре. Согласно этому закону, при увеличении давления на газ, его объем уменьшается, и наоборот – при уменьшении давления, объем газа увеличивается. Формула для уравнения Бойля-Мариотта проста: P1V1 = P2V2, где P1 — начальное давление газа, V1 — начальный объем газа, P2 — конечное давление газа и V2 — конечный объем газа.
Зиценко привнес в уравнение Бойля-Мариотта новый аспект, исследуя зависимость объема газа от температуры. Он обнаружил, что при постоянном давлении и изменении температуры, объем газа также меняется. Зиценко учел это явление и внес поправку в уравнение Бойля-Мариотта, добавив коэффициент температуры. Таким образом, модифицированное уравнение для объема газа при изменении давления и температуры можно записать как P1V1/T1 = P2V2/T2, где Т1 и Т2 – начальная и конечная температуры соответственно.
Исследования Зиценко помогли еще точнее определить поведение газов и усовершенствовать уравнение Бойля-Мариотта. Его вклад в развитие науки и прогресс заслуживает признания и восхищения, а уравнение Бойля-Мариотта остается одним из основополагающих законов в газовой физике и химии.
Закон Бойля-Мариотта на практике: применение в технике
Применение Закона Бойля-Мариотта в технике основано на его связи между объемом и давлением газа. Например, в автомобильных двигателях применяется принцип сжатия воздушно-топливной смеси. Когда поршень двигателя опускается, объем цилиндра уменьшается, что приводит к повышению давления сжатого воздуха и топливной смеси. Затем, при восходящем движении поршня, происходит взрыв топлива, который ведет к движению поршня и созданию силы, необходимой для привода автомобиля.
Также, Закон Бойля-Мариотта применяется в газовых системах, например, в газовых баллонах и цилиндрах. Давление газа в таких системах зависит от его объема. Сжатие или расширение газа приводит к изменению его давления. Поэтому, при использовании газовых баллонов, важно учитывать закономерности Закона Бойля-Мариотта для обеспечения безопасности и эффективности работы оборудования.
Другой пример применения Закона Бойля-Мариотта в технике – воздушные компрессоры. Компрессоры сжимают воздух, уменьшая его объем и повышая давление. Это позволяет использовать сжатый воздух для таких задач, как накачивание шин, покраска автомобилей, запуск пневматических инструментов и многие другие.
Вопрос-ответ:
Какой закон описывает суть закона Бойля-Мариотта?
Суть закона Бойля-Мариотта описывается идеальным газом, и гласит, что при постоянной температуре, объем идеального газа обратно пропорционален давлению.
Как формулируется закон Бойля-Мариотта?
Закон Бойля-Мариотта формулируется следующим образом: при постоянной температуре, объем идеального газа изменяется обратно пропорционально его давлению. Или, в математической форме: P1 * V1 = P2 * V2, где P1 и V1 — начальное давление и объем, а P2 и V2 — конечное давление и объем соответственно.
Каковы основные принципы закона Бойля-Мариотта?
Основные принципы закона Бойля-Мариотта можно сформулировать так: при увеличении давления газа, его объем уменьшается, и наоборот, при уменьшении давления, объем газа увеличивается. При этом, эти изменения происходят при постоянной температуре.
Какие факторы влияют на выполнение закона Бойля-Мариотта?
Выполнение закона Бойля-Мариотта зависит от нескольких факторов. Во-первых, нужно, чтобы газ, с которым вы работаете, был идеальным, то есть его молекулы не взаимодействуют друг с другом. Во-вторых, температура газа должна оставаться постоянной во время эксперимента. И, наконец, установка, в которой проводится эксперимент, должна быть герметичной, чтобы не было утечек газа.
Каким образом закон Бойля-Мариотта применяется на практике?
Закон Бойля-Мариотта имеет множество практических применений. Например, он используется для расчета объемов газовых смесей при различных давлениях, для определения эффективности работы двигателей внутреннего сгорания, а также для проектирования систем водоснабжения и компрессоров.
Что такое закон Бойля-Мариотта?
Закон Бойля-Мариотта описывает зависимость между давлением и объемом газа при постоянной температуре. Он гласит, что при постоянной температуре количество газа увеличивается при уменьшении давления, и наоборот.