Периодический закон – одно из важнейших понятий в химии, которое помогает систематизировать и классифицировать химические элементы. Открытый в XIX веке русским химиком Дмитрием Менделеевым, этот закон позволяет предсказывать свойства и характеристики элементов, а также определять их положение в периодической системе.
Периодический закон основан на представлении атома как основного строительного блока химических элементов. Атом состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, движущихся по орбитам вокруг ядра. Электроны на орбитах распределены в энергетических уровнях. Каждый элемент имеет свою атомную структуру, определяющую его свойства и положение в периодической таблице.
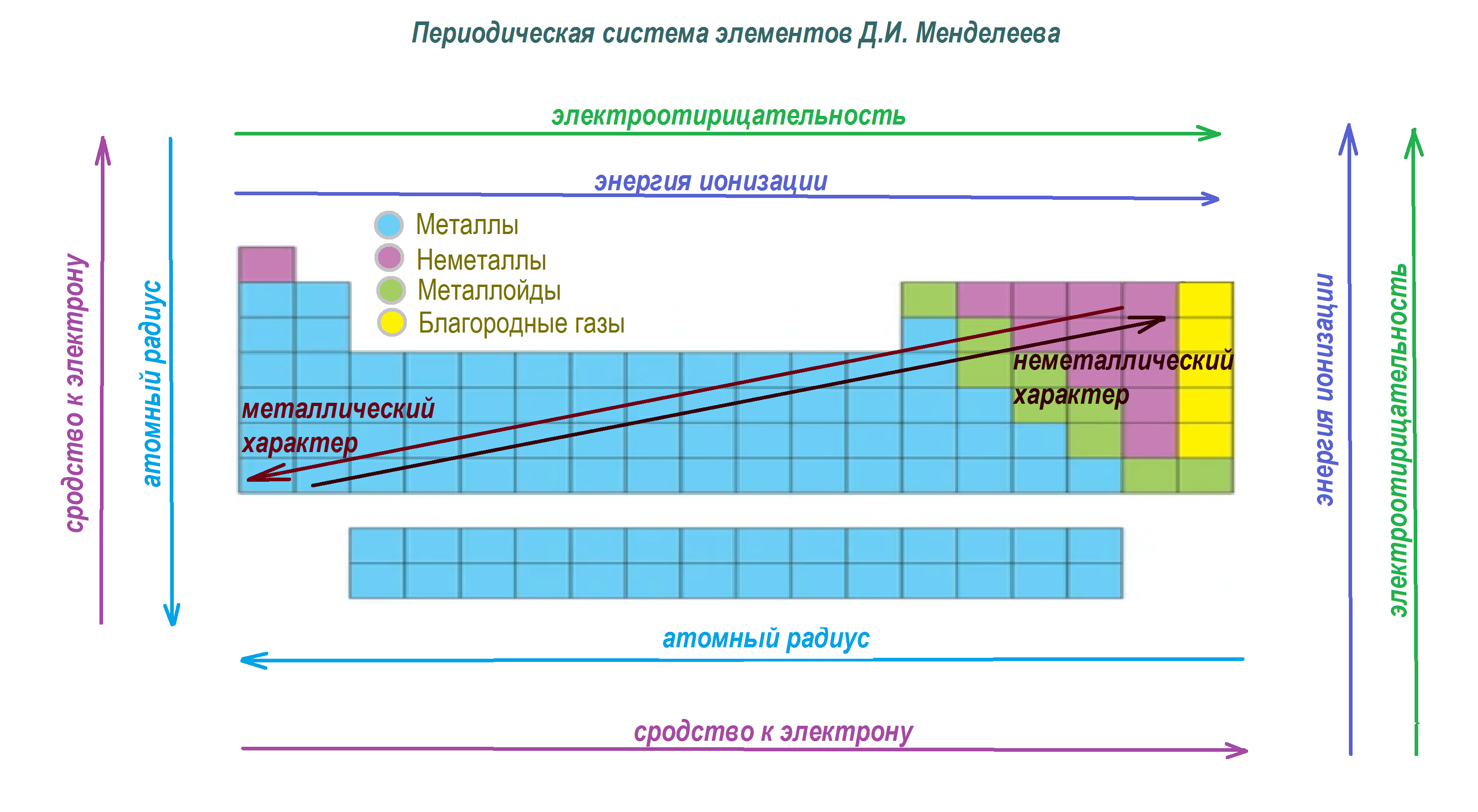
Периодический закон устанавливает закономерности в изменении свойств элементов по мере движения слева направо и сверху вниз в периодической системе. Элементы разделены на периоды и группы, в которых располагаются аналогичные по своим химическим свойствам элементы. Отображение периодического закона в периодической таблице помогает упорядочить более став элементов и систематизировать их свойства.
Периодический закон
Периодический закон позволяет организовать элементы в таблицу химических элементов, известную как таблица Менделеева. В этой таблице элементы расположены в порядке возрастания атомных номеров и систематизированы по группам и периодам в соответствии со своими химическими свойствами.
Периодический закон имеет множество практических применений. Он позволяет ученым предсказывать свойства новых элементов, исследовать их химическую реактивность, разрабатывать новые материалы и соединения. Благодаря периодическому закону, мы можем лучше понять и объяснить мир химических элементов и использовать этот знакомый порядок для достижения новых научных открытий и прорывов в области химии.
Определение периодического закона
Периодический закон основан на том, что электроны в атоме расположены в энергетических уровнях и субуровнях. По мере увеличения атомного номера, количество электронов увеличивается, что приводит к появлению новых энергетических уровней и субуровней. Каждый новый энергетический уровень или субуровень добавляют электронные оболочки к атому и влияют на его свойства.
Периодический закон включает в себя ряд явлений, включая периоды и группы в таблице Менделеева, атомные и ионные радиусы, электроотрицательность и многие другие. Он позволяет установить тенденции и закономерности в химических свойствах элементов, что облегчает их классификацию и изучение.
Развитие представления об элементах
Начало XX века стал переломным моментом в развитии представления об элементах. С помощью различных физических и химических экспериментов, ученые смогли определить, что все вещества состоят из атомов. Было установлено, что атомы различаются по своему химическому поведению и физическим свойствам.
Дальнейшие исследования показали, что атомы состоят из податомных частиц: электронов, протонов и нейтронов. Эти открытия привели к формулировке новой концепции строения атома, известной как «ядерно-электронная модель». Согласно этой модели, электроны обращаются вокруг ядра, которое содержит протоны и нейтроны.
Кроме того, ученые открыли, что существует огромное разнообразие элементов, каждый из которых имеет свое место в периодической таблице. Периодическая таблица элементов была разработана Д. И. Менделеевым в 1869 году и с тех пор стала важным инструментом для организации и классификации элементов. Она позволяет упорядочить элементы по возрастанию атомных номеров и предсказывать их свойства.
С появлением квантовой механики в первой половине XX века, представление об атомах стало все более точным. Квантовая механика описывает поведение электронов в атоме с помощью математических уравнений и понятий, таких как орбитали и энергетические уровни. Эти открытия привели к пониманию того, что строение атома намного сложнее, чем просто электроны, протоны и нейтроны.
Строение атома
Атом состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Количество протонов в ядре определяет химические свойства атома и называется атомным номером.
Вокруг ядра находится электронная оболочка, которая содержит электроны. Электроны имеют отрицательный заряд и движутся по определенным орбитам или энергетическим уровням. Количество электронов в атоме равно количеству протонов, так как атом является электрически нейтральным.
Электроны располагаются на оболочках в порядке возрастания энергетических уровней. Главная оболочка имеет наибольшую энергию и может содержать до 2 электронов, первая оболочка — до 8 электронов, вторая — до 18 электронов и так далее. Электроны на внешней оболочке называются валентными и определяют химическую активность атома.
Строение атома позволяет объяснить его физические и химические свойства. Изменение числа электронов на валентной оболочке взаимодействует с другими атомами и вызывает образование химических соединений.
Идея о строении атома
В начале XX века физики открыли, что атомы состоят из позитивно заряженного ядра и отрицательно заряженных электронов, которые орбитально вращаются вокруг ядра. Это открытие было сделано благодаря экспериментам, проведенным Эрнестом Резерфордом и другими учеными.
Строение атома можно представить следующим образом:
- Ядро атома — это его центральная часть, состоящая из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Они держатся вместе с помощью сильного ядерного взаимодействия.
- Электроны — это отрицательно заряженные частицы, которые вращаются вокруг ядра на определенных энергетических уровнях или орбитах. Эти энергетические уровни задаются квантовыми числами и определяют возможные места, где электроны могут находиться.
Согласно модели Резерфорда, атом представляет собой небольшую плотную область (ядро) с положительным зарядом в центре и облако электронов, размещенных на определенных дистанциях от ядра. Наиболее вероятные области обитания электронов называются орбиталями или энергетическими уровнями.
С развитием квантовой механики, представление о строении атома стало более сложным и точным. Было установлено, что электроны не движутся по четким орбитам, а скорее являются математической вероятностью обнаружения в определенных областях пространства. Эти области называются орбиталями или квантовыми оболочками. Орбитали имеют разную форму и размер, которые определяются квантовыми числами.
Модель атома Бора
Модель атома Бора была предложена датским физиком Нильсом Бором в 1913 году и стала первой успешной попыткой описания строения атома. В основе модели лежит понятие энергетических уровней, на которых располагаются электроны.
Согласно модели атома Бора, атом состоит из центрального ядра, вокруг которого движутся электроны по определенным орбитам или энергетическим уровням. Каждому энергетическому уровню сопоставляется определенная энергия, и электроны способны перемещаться между уровнями, поглощая или испуская энергию в виде фотонов.
Модель атома Бора успешно объясняет ряд явлений, таких как линейчатый спектр водорода и определенные правила расположения электронов на энергетических уровнях. Однако она имеет свои ограничения и не может объяснить некоторые явления, например, дискретность спектра других элементов и собственную механику движения электронов.
Модель атома Бора стала отправной точкой для развития квантовой механики и более сложных моделей атомов, таких как модель атома Шрёдингера. Однако она остается важным историческим этапом в понимании строения атома и принципов его функционирования.
| Орбита | Энергия |
|---|---|
| К | -13.6 эВ |
| L | -3.4 эВ |
| M | -1.51 эВ |
| N | -0.85 эВ |
Электронные оболочки атома
Атом состоит из ядра, содержащего протоны и нейтроны, и электронных оболочек, в которых находятся электроны. Количество электронов в атоме определяет его заряд и химические свойства.
Вокруг ядра атома находятся электронные оболочки, которые представляют собой энергетические уровни. Каждая оболочка может вмещать определенное количество электронов:
- Первая оболочка — может вместить максимум 2 электрона.
- Вторая оболочка — может вместить максимум 8 электронов.
- Третья оболочка — может вместить максимум 18 электронов.
- И так далее.
Порядковый номер строительного элемента определяет количество электронов в атоме. Например, атом водорода имеет один электрон на первой оболочке, атом кислорода — 2 электрона на первой оболочке и 6 электронов на второй оболочке.
Электроны в атоме располагаются на оболочках в порядке возрастания энергии. То есть на первую оболочку в первую очередь располагается один электрон, на вторую оболочку — два электрона и так далее.
Электронные оболочки атома играют важную роль в химических реакциях и связывании атомов между собой. Понимание и изучение электронных оболочек атома позволяет нам лучше понять и объяснить многие химические явления и свойства веществ.
Вопрос-ответ:
Какой периодический закон описывает конспект?
Конспект описывает периодический закон Менделеева, который представляет собой закономерное повторение свойств химических элементов по возрастанию их атомных номеров.
Каково строение атома и как оно связано с периодическим законом?
Строение атома состоит из ядра, состоящего из протонов и нейтронов, а также облака электронов вокруг ядра. Периодический закон связан с электронной структурой атомов и определяет расположение элементов в таблице Менделеева по их атомным номерам и электронной конфигурации.
Какие факторы определяют положение элемента в периодической таблице?
Положение элемента в периодической таблице определяется его атомным номером (количество протонов в ядре), электронной конфигурацией и химическими свойствами.
Какие основные закономерности можно увидеть в периодическом законе?
В периодическом законе можно увидеть несколько основных закономерностей: постепенное увеличение атомного радиуса и ионного радиуса элементов в периодах, изменение электроотрицательности от металлов к неметаллам, изменение энергии ионизации и электроаффинности.
Какая роль периодического закона в химии и науке в целом?
Периодический закон играет важную роль в химии и науке в целом. Он позволяет систематизировать и классифицировать химические элементы, прогнозировать их свойства и взаимодействия, а также открывать и исследовать новые элементы и химические соединения.
Каково строение атома и как оно связано с периодическим законом?
Строение атома состоит из ядра, в котором содержатся протоны и нейтроны, и электронной оболочки, в которой находятся электроны. Периодический закон устанавливает закономерность в расположении химических элементов в таблице, и эта закономерность объясняется строением атома. В частности, периодический закон основан на том, что химические свойства элементов определяются расположением их электронов.